

李斯 尹明洁 米颖 孙雅楠*
作者单位:063000 河北省唐山市工人医院心内四科(李斯、米颖);内分泌二科(尹明洁、孙雅楠)* 通讯作者
【摘要】 目的 评估miR-9-3p 对ATP 结合盒转运蛋白A1(ATP-binding cassette transporter A1,ABCA1)基因及蛋白表达的影响。方法 采用HepG2 细胞,应用细胞培养、miR-9-3pmimics 转染、实时定量PCR 技术(qRT-PCR)以及Western blotting 免疫印迹等实验技术,分析miR-9-3p 对细胞ABCA1 mRAN 及蛋白表达水平的影响。结果 ① miR-9-3p 转染组miR-9-3p 水平较对照组显著升高,差异有统计学意义(P <0.001),证明转染成功;②两组ABCA1 mRNA 水平比较,差异无统计学意义(P >0.05);③ miR-9-3p 转染组ABCA1 蛋白水平较对照组显著降低,差异有统计学意义(P <0.05)。结论 miR-9-3p 能够抑制细胞内ABCA1 蛋白表达,但对转录水平未见显著影响。
【关键词】 miR-9-3p;HepG2 细胞;ATP 结合盒转运蛋白A1;细胞转染;Western blotting 免疫印迹
中图分类号 Q78;R541.4 文献标识码 A 文章编号 1671-0223(2023)06-406-03
miR-9-3p 是microRNA 家族成员之一,在机体血管发育过程以及血管性疾病如动脉栓塞及狭窄过程中产生作用,研究表明其对于血管内皮细胞迁移、心肌细胞的增生等过程具有调节作用,但其是否在冠心
病相关基础病变中产生作用,尚未见报道[1-2]。然而,miR-9-3p 与动脉粥样硬化性疾病的关系及其作用机制尚不明确。在之前的研究中发现,不稳定型心绞痛患者血浆miR-9-3p 表达水平显著低于正常人[3],
但miR-9-3p 是否通过调节冠心病的危险因素- 血脂发挥作用尚未表明。ATP 结合盒转运蛋白A1(ATP-binding cassette transporter A1,ABCA1)是体内胆固醇逆转运调节因子,发挥胆固醇逆向转运至肝脏,形成胆汁酸排除,其在胆固醇表达水平方面发挥重要作用[4],关于miR-9-3p 是否对细胞ABCA1 表达水平进行调节,未见报道。HepG2 细胞是肝细胞类型之一,能够模拟肝细胞代谢过程,本实验以此细胞为研
究对象,探讨miR-9-3p 是否对细胞ABCA1 的表达产生影响。
1 资料与方法
HepG2 细胞购自中国协和医科大学附属医学院细胞实验室。
1.1 细胞经传代培养后进行转染实验
将HepG2 细胞用PBS 洗2 次,将配制好的miR-9-3p 转染复合物,分别加入到6 孔板中,加入Opti-MEM 培养基750μl/ 孔,混合均匀,于 37℃、5.0%CO2、饱和湿度条件的培养箱中培养24h。
1.2 细胞qRT-PCR
1.2.1 细胞总RNA 的提取 转染实验结束后轻柔剥离细胞,使细胞脱落并进一步应用裂解液裂解,吸取上清液,加入等体积的异丙醇加入离心管,留取试管底部白色沉淀物,吸取75% 的乙醇1ml 缓慢沿管壁加入离心管,离心后弃去。于室温下干燥5min,使乙醇完全挥发,加入70 ~ 80μl DEPC 处理水溶解沉淀,待miRNA 沉淀完全溶解后,-80℃冰箱保存。
1.2.2 细胞mRNA qRT-PCR 引物序列:
ABCA1:5'ATGTGGAGTTCTTTGCCCTCCTGA3'(上游)
5'CTTTCGTTTGTTGCCGCCACTGTA3'(下游)
β-actin:5'ACAGAGCCTCGCCTTTGC3'(上游)
5'CCACCATCACGCCCTGG3'(下游)
以β-actin 作为本部分实验的内参, 配置反应体系为:2×Step SYBR®RT-PCR Buffer 4 10μl、PrimeScript 1 Step Enzyme Mix 2 1.0μl、PCR Forward Primer(10μM)1.0μl、PCR Reverse 引物(10μM)1.0μl、总RNA4.0μl、无酶水3μl,总反应体系一共20μl。
反转录条件:42℃ 30min、95℃ 10min 1 个循环,PCR 反应条件:95℃ 10s、60℃ 60s 40 循环。实验结束后记录反应的Ct 值,进行实验统计。
1.3 Western blot
1.3.1 细胞总蛋白的提取 实验细胞完成miR-9-3pmimics 转染后,实验应用缓冲液清洗3 次之后再应用RIPA 裂解液,使实验细胞进行充分的裂解,并获得细胞内的总蛋白水平。再应用考马斯亮蓝方法检测细胞内的总蛋白水平,之后进行SDS-PAGE 电泳。电泳实验后,取目的蛋白条带,并进一步设定为恒流的200 毫安进行转膜1h。转膜实验完成之后,将膜用TBST 的缓冲液进行清洗,在摇床机上进行封闭1h。配制一抗体以及一抗稀释液,将封闭好的膜放入配好的一抗稀释液,4℃摇床进行过夜。配制二抗与二抗稀释液,将封闭后的膜放入配好的二抗稀释液,常温下载摇床机上摇3h。经过二抗孵育完成之后,应用TBST 缓冲液进行清洗3 次,加入显色液,并记录实验的结果。
1.3.2 考马斯亮蓝法测蛋白浓度 实验用分光光度,进行测定并仔细的计算每个实验管中蛋白的吸光度值,并且制作出本实验的标准曲线。首先吸取3μl的待测蛋白液体,加入到100μl 的考马斯亮蓝显色液之中,再次应用分光光度,详细的计量,并仔细的计算出吸光度值,再次计算出需要检测的蛋白浓度。
1.3.3 电泳分离蛋白分子并进行转膜 首先将膜放入封闭液中,并在摇床上进一步的进行封闭1h。第一步加一抗,在4℃中维持,并在摇床上过夜。第二步加二抗,在常温中维持,并在摇床上持续摇3h,二抗孵育完成后,经TBST 洗涤3 次,并加显色液在凝胶成像系统显色,记录实验结果。
1.4 数据处理方法
采用SPSS 17.0 统计软件分析数据,计量资料使用“±s”表示,组间均数比较采用独立样本t 检验,P <0.05 为差异具有统计学意义。
2 结果
2.1 miR-9-3p 转染效率
miR-9-3p 转染组细胞中miR-9-3p 表达水平21.692±3.150, 对照组1.342±0.554,miR-9-3p 转染组显著升高,差异有统计学意义(P <0.05),证明转染实验成功,见表1。

2.2 miR-9-3p 对ABCA1 基因mRNA 转录水平的影响
miR-9-3p 转染组ABCA1 mRNA 水平为1.293±0.562,对照组为1.162±0.576,两组相比, 差异无统计学意义(P >0.05),见表2。
2.3 miR-9-3p 对ABCA1 蛋白水平的影响
miR-9-3p 转染组ABCA1 的蛋白水平0.426±0.122,对照组0.783±0.134,miR-9-3p 转染组显著低于对照组,差异有统计学意义(P <0.05),见图1,表3。
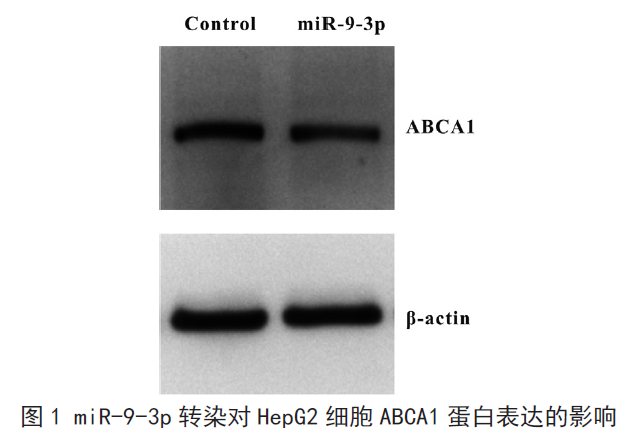

3 讨论
冠心病(coronary heart disease,CHD)是目前我国乃至世界范围内威胁人类健康的第一大慢性疾病。随着时代的变迁,CHD 的发病率及治病率、致死率逐年增高,CHD 是心肌梗死乃至心源性猝死的前驱期表现,如不早期发现、诊断CHD 并预防进展,那将降低人类平均寿命及生存质量。
CHD 的危险因素包括心脑疾病家族史、既往心血管疾病病史、高血压、男性、老龄、吸烟及高血糖、高血脂等代谢性疾病,然而,血脂代谢紊乱,尤其是胆固醇及低密度脂蛋白代谢异常往往是导致动脉粥样硬化的独立危险因素[5]。ABCA1 是位于细胞膜上的三磷酸腺苷结合盒转运受体是调节血脂代谢的关键因子,目前研究其功能显示,在胆固醇转运过程即将血液中的胆固醇以及脂代谢物质逆转运至肝脏,在肝脏进一步通过代谢变为胆汁酸排除体外[6-7]。在胆固醇转运的过程中许多组织参与其中,主要包括肝脏、肠道、血管等,ABCA1 的主要分布范围为巨噬细胞、肝脏细胞、小肠细胞、血管内皮等多种细胞的细胞膜,在血脂代谢的逆转运过程发挥重要作用[8-9]。
目前的研究报道显示,如建立ABCA1 表达减少的小鼠模型,可以观察到小鼠发生动脉粥样硬化的比率显著增高,并且病症重,血管狭窄程度重[10]。目前miRNAs 对ABCA1 在胆固醇代谢方面的调控作用已
有报道,有研究学者Xu 等[11] 概述了miR-34a 在调节巨噬细胞胆固醇流出、炎症和动脉粥样硬化中的中心作用,其可能是通过调节细胞ABCA1 表达水平发挥作用,研究进一步表明miR-34a 是治疗心脏代谢疾
病的一个有前途的靶点。循环中miR-106a-5p/miR-320a,其作为ABCA1/CPT1 的上游靶向抑制剂,协同调节酒精性脂肪肝的进展,导致ABCA1 表达水平显著减少,诱导脂质代谢紊乱在酒精性脂肪肝发病中发
挥协同作用[12]。还有研究显示miR-33a 和miR-144的表达增加,其靶ABCA1 的表达呈负相关;它可能与患者的原发性动脉高压相关,并因此导致动脉粥样硬化斑块[13]。 还有研究表明,与转染miR-200b-3p
抑制剂和小干扰物-ABCA1 的泡沫细胞相比,转染miR-200b-3p 抑制剂的泡沫细胞中的脂质含量显著增加,而胆固醇流出量显著降低。miR-33 在体内的沉默增加了ABCA1 的肝表达和血浆HDL 水平。因此,
miR-33 似乎同时调节肝脏中的HDL 生物发生和细胞胆固醇流出[14]。
学者研究显示,不稳定型心绞痛患者血浆miR-9-3p 表达水平相较于正常人显著降低,通过受试者工作特征曲线表明其对于不稳定型心绞痛具有一定诊断价值[3]。因此研究miR-9-3p 与ABCA1 表达水平的
关系,能够从基因层面深入阐述CHD 患者其胆固醇代谢调节异常的真正原因。本研究发现miR-9-3p 转染组HepG2 细胞ABCA1 蛋白水平显著低于阴性对照组,而miR-9-3p 转染组与对照组相比ABCA1 mRNA
表达水平无显著性差异,提示miR-9-3p 可能通过转录后水平蛋白翻译等过程参与ABCA1 蛋白表达的调控。目前已经有研究证实miR-9-3p 在胆固醇代谢的调节酶如脂肪酰辅酶A 基因具有调节作用,能够调节胆固醇代谢等[15],该研究也证实其具有调节脂代谢因子表达的作用。
综合以上,miR-9-3p 能够抑制脂蛋白调节因子ABCA1 蛋白表达,但对ABCA1mRNA 水平未见显著影响,可能是通过转录后翻译等过程对其蛋白表达产生影响,确切机制有待于之后的研究进一步证实。
4 参考文献
[1] Zhuang G, Wu X, Jiang Z, et al. Tumour-secreted miR-9 promotes endothelial cell migration and angiogenesis byactivating the JAK-STAT pathway[J]. EMBO, 2012,31(17):3513-3523.
[2] Zhang J, Chintalgattu V, Shih T, et al. MicroRNA-9 is an activation induced regulator of PDGFR-beta expression in cardiomyocytes[J]. Mol Cell Cardiol, 2011,51(3): 337-346.
[3] 李斯, 孙雅楠. 不稳定型心绞痛患者miR-9-3p 水平及临床意义[J]. 中国老年学杂志,2019,39(11):2583-2586.
[4] 程爱娟, 毛用敏, 崔让庄.ABCA1 基因启动子区-14bp和ZNF 位点多态性与血脂水平及冠心病易感性的关联分析[J]. 中华医学遗传学杂志,2012,29(1):56-59.
[5] 王波, 王临池, 赵翼洪, 等.2009-2013 年苏州20 岁及以上居民冠心病发病率变化趋势及类型分析[J]. 中国全科医学,2015(24):2952-2956.
[6] Schmitz G,Buechler C.ABCA1:Regulation, trafficking and association with heteromeric proteins[J].Ann Med,2002,34:334-347.
[7] Srivastava N.ATP-binding cassette transporterA1-key roles in cellular lipid transport and atherosclerosis[J].Mol Cell Biochem,2002,237:155-164.
[8] Oram JF,LawnRM.ABCA:The gatekeeper for eliminating excess tissue cholesterol[J].Lipid Res,2001,42:1173-1179.
[9] Singaraja RR,Brunham LR,Visscher H,et al.Efflux and athero-sclerosis the clinical and biochemical impactofvariations in the ABCA1 gene[J]. Arterioscler Thromb Vasc Bio,2003,200:1322-1332.
[10] V a i sma n B L , L a m b e r t G , A m a r M , e t a l . A B C A 1 overexpression leads to hyperalphalipoproteinemia and increased biliary cholesterol excretion in transgenicmice[J]. J Clin Invest, 2001,108(2):303-309.
[11] Xu Y, Xu Y, Zhu Y, et al. Macrophage miR-34a is a key regulator of cholesterol efflux and atherosclerosis[J].Mol Ther,2020,28(1):202-216.
[12] Li J, Qi J, Tang Y, et al. A nanodrug system overexpressed circRNA_0001805 alleviates nonalcoholic fatty liver disease via miR-106a-5p/miR-320a and ABCA1/CPT1 axis[J].J Na
nobiotechnology,2021,19(1):363.
[13] Huesca-Gómez C,Torres-Paz YE,Martínez-Alvarado R,et al.Association between the transporters ABCA1/G1 and the expression of miR-33a/144 and the carotid intima media thickness in patients with arterial hypertension[J].Mol Biol Rep,2020,47(2):1321-1329.
[14] Rayner KJ,Suárez Y,Dávalos A,et al.MiR-33 contributes to the regulation of cholesterol homeostasis[J].Science,2010,328(5985):1570-1573.
[15] Xu J, Hu G, Lu M, et al. MiR-9 reduces human acylcoenzyme A:cholesterol acyltransferase-1 to decrease THP-1 macrophage-derived foam cell formation[J].Acta Biochim Biophys Sin (Shanghai),2013,45(11):953-962.
[2023-01-09 收稿]
上一篇:没有了!
下一篇:没有了!